阳极液
阳极液
SDS-PAGE分析确定电化学活化水对铜绿假单胞菌和大肠杆菌的抗菌机制
目的
将细菌暴露于阳极液,然后研究阳极液对处理过的细菌蛋白质谱的影响。
方法和结果
从用不同浓度阳极液处理的细菌中提取蛋白质,并使用 SDS-PAGE 进行分析。与未经处理的细菌相比,浓缩卤化物阳极电解液处理的细菌观察到更少和更微弱的蛋白质条带,而暴露于稀释浓度的细菌则观察到额外的蛋白质条带。
结论
卤化物衍生阳极液的未稀释和 10)1 稀释液可有效杀死测试细菌。阳极液通过完全破坏蛋白质或通过引起导致蛋白质片段化的氧化应激而导致细菌死亡。
研究的意义和影响
这项研究的结果提供了关于阳极液对其他细菌的抗菌机制的信息,而这些信息目前是不可用的。
介绍
细菌对大多数常用杀菌剂的耐药性在各种应用中具有严重的经济和环境影响。其中包括冷却水、造纸、医疗植入物、饮用水分配和食品加工(Cloete 2003)。这就需要寻找新的有效和环保的替代品。电化学活化 (ECA) 水是开发的替代品之一。各种研究人员已经对 ECA 制水过程进行了详细描述(Leonov 1997;Marais 和 Bro¨zel 1999;Rogers 等人,2006)。通过电化学活化产生两种类型的溶液。阴极电解液具有负氧化还原电位 (ORP),阳极电解液具有正 ORP (Marais and Bro¨zel 1999; Al-Haq et al. 2002)。阳极液具有抗菌作用,并已用于控制各个领域微生物生长的研究(Marais 和 Bro¨zel 1999;Selkon 等人 1999;Middleton 等人 2000;Marais 和 Williams 2001;Rogers 等人 2006 ;El karim 等人,2007 年)。Thantsha 和 Cloete (2006) 指出使用 ECA 水可以有效去除和控制与配水系统和工业冷却水相关的生物膜。杨等人。(1999) 和 Russell (2003) 研究了 ECA 水减少鸡蛋和家禽尸体上微生物污染物的能力。Thantsha 和 Cloete (2006) 指出使用 ECA 水可以有效去除和控制与配水系统和工业冷却水相关的生物膜。杨等人。(1999) 和 Russell (2003) 研究了 ECA 水减少鸡蛋和家禽尸体上微生物污染物的能力。Thantsha 和 Cloete (2006) 指出使用 ECA 水可以有效去除和控制与配水系统和工业冷却水相关的生物膜。杨等人。(1999) 和 Russell (2003) 研究了 ECA 水减少鸡蛋和家禽尸体上微生物污染物的能力。
上述研究的结果证实了 ECA 水杀死微生物的能力。阳极电解液的 ORP 值介于 +700 和 +1000 mV 之间(Marais 和 Bro¨zel 1999;Al-Haq 等人 2002;Deza 等人 2003)。ORP 是溶液氧化和还原活性的量度(Banhidi 1999)。氧化剂残留量、水的“氧化电位”与 ORP mV 读数之间存在直接相关性(Kelly 2004)。较高的正 ORP 值表示强氧化能力 (Park et al. 2004)。细菌暴露于来自内源或外源的氧化化合物会诱发氧化应激(Rowbury 和 Goodson 1999;Shackelford 等人 2000)。研究表明,+650 mV 至 700 mV 的 ORP 值将在几秒钟内杀死细菌(Suslow 2000;Zinkevich 等人 2000)。因此,
尽管 ECA 溶液具有抗菌特性,但杀死细菌的确切机制尚不清楚(Al-Haq 等人,2002 年)。杀菌剂通过靶向几种结构或大分子或生化途径来杀死微生物(Denyer 和 Stewart 1998;McDonnell 和 Russell 1999;Russell 1999)。ECA 溶液的高氧化电位可通过氧化细胞表面的巯基化合物和其他关键代谢物来抑制微生物生长(Park 等人,2004 年)。ECA 溶液具有消除或破坏细菌内生孢子的能力(Rogers 等人,2006 年)。由于它们能够减少内生孢子,因此它们可能具有影响孢子外壳以使孢子失活的能力。内生孢子的结构,尤其是孢子外壳,是由蛋白质组成的(Rogers 等人,2006 年)。因此,如果 ECA 水影响孢子蛋白,那么营养细胞的死亡可能是由于 ECA 溶液和细胞蛋白之间的接触。津克维奇等人。(2000) 研究了 ECA 水对大肠杆菌的作用机制。他们表明在暴露后 5 分钟内核酸和蛋白质被完全破坏。十二烷基硫酸钠聚丙烯酰胺凝胶电泳 (SDS-PAGE) 是将蛋白质解离成单个链并根据其分子量分离它们的强大工具(Jason 和 Ryden 1998;Walker 2002)。因此,SDS-PAGE 是一种用于证明抗菌效果的理想技术,并且以前已用于研究细菌的耐药机制(Brozel 和 Cloete 1993)。
材料和方法
细菌培养
本研究中使用的铜绿假单胞菌、金黄色葡萄球菌、枯草芽孢杆菌(植物体)和大肠杆菌来自比勒陀利亚大学微生物学和植物病理学系培养物保藏中心。将培养物维持在营养琼脂平板上,每 2 周传代培养一次。革兰氏染色用于检查纯度。阳极电解液由南非约翰内斯堡的 Radical Waters Ltd 提供。这些溶液在 4°C 下储存并在 24 小时内使用。阳极电解液氯化钠储备溶液 (2×5 升)1) 的生产是在软化水中制成的,碱度为 <20 毫克升)1。将该储备溶液以 700 ml min)1 的速率进料到两个反应器装置中。反应器系统预设为生产具有接近中性 pH 值 (pH 6†8-7) 的阳极液,电源预设为每个电极反应器 12 V 和 5 A。测量了阳极液的物理化学性质(表 1)。
阳极液的性质
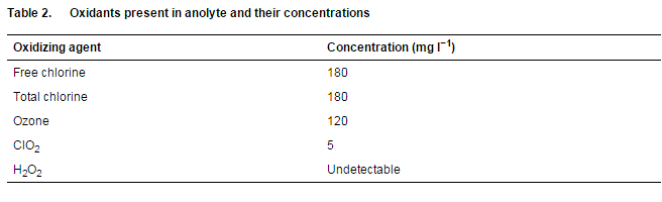
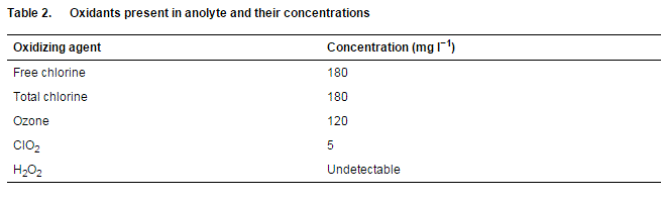
在使用溶液之前测量氧化还原电位 (ORP)、电导率 (EC)、温度和 pH 值。使用具有可更换双结氯化银 (AgCl) 电极和 1 mV 分辨率的防水 ORPScan(双结)测量阳极液溶液的 ORP。使用带有可更换电极、温度显示和 0×01 毫秒分辨率的防水 ECScan 测量电导率和温度。使用防水 pHScan 2 测试仪测量 pH 值。所有探针均来自新加坡 Eutech Instruments Pte Ltd. 的 Thermo Fisher Scientific, Inc.。根据制造商的说明,使用各自的 Spectroquant 测试套件 [Merck Chemicals (Pty) Ltd, Modderfontein, South Africa] 测定阳极电解液中存在的氧化剂水平。
最低抑菌浓度的测定
培养物在营养琼脂 (NA) 板上生长,并在 37°C 下培养 24 小时。用新鲜制备的 0×25 强度林格溶液 [Merck Chemicals (Pty) Ltd] 悬浮在 NA 板上过夜的培养物。将 1 ml 每种细菌悬浮液添加到四个不同的试管中,每个试管含有不同浓度的阳极液 [未稀释的,10)1、10)2 和 10)3(阳极液:林格溶液)]。对照管含有 1 ml 菌悬液和 9 ml 0×25 浓度的林格溶液。加入培养物后涡旋管子,然后从每个管子中取出 100 μl 作为 0 h 样品。所有试管在室温下孵育 6 h,然后取另一个样品进行细菌计数。由于样品的稀释会消除溶液中的抗微生物作用,因此未添加中和剂(Middleton 等人 2000;Cloete 2003)。100 ll 等分试样在 0×25 强度的林格溶液中连续稀释(从 10)1 到 10)6),并一式两份地铺在 NA 板上。将板在 37oC 下孵育 24 小时。导致细菌完全消除(板上没有生长)的最低阳极液浓度被认为是最小抑制浓度(MIC)。
确定最短曝光时间
将 NA 板上的 24 小时培养物悬浮在新鲜制备的 0×25 强度林格溶液中。将 1 ml 细菌悬浮液添加到 9 ml 上述测定的阳极液的 MIC 中。对于对照,将 1 ml 细菌悬浮液添加到 9 ml 0×25 强度的林格溶液中。管在室温下孵育6小时。在混合后(0 分钟)和 5、10、15、20、25、30 和 60 分钟后立即从每个管中取出 100 微升样品。制备样品的系列稀释液,然后将 100 μl 适当的稀释液一式两份地分布在 NA 板上。将板在37°C温育24小时。以具有杀菌作用的最短暴露时间为最短暴露时间。
SDS-PAGE 样品制备
铜绿假单胞菌和大肠杆菌细胞在 37oC 的 NA 板上生长 24 小时,并悬浮在 20 ml 0×25 强度的林格溶液中。将悬浮液转移到 BD FalconTM 50 ml 管(BD Biosciences,New Jersey,USA)中并使用 Eppendorf Centrifuge 5804R(Merck Chemicals (Pty) Ltd)以 10×5 g 离心 10 分钟。弃去上清液,用 20 ml pH 6×8 的磷酸盐缓冲液(112×5 ml 0×2 mol l)1 NaH2PO4×2H2O + 137×5 ml 0×2 mol l)洗涤沉淀四次1 Na2HPO4×12H2O)。将沉淀重新悬浮在 1 ml 磷酸盐缓冲液中,然后转移到预先称重的 Eppendorf 管中。以 10×5 g 离心细胞 11 分钟,弃去上清液。通过称重试管来确定颗粒的质量。将 100 微升 20% SDS 与 900 微升 STB(样品处理缓冲液)混合以用于蛋白质。将 100 μl SDS-STB 溶液添加到沉淀中并在 96°C 下加热 3 分钟。使用超声波匀浆器 4710(Cole-Palmer,Chicago)通过超声处理约 5 秒裂解细胞,使用 15 脉冲输出 (40 W) .再加入 100 μl SDS-STB 混合物,以 10×5 g 离心细胞 11 分钟。根据 Ehlers (1997) 将上清液转移到无菌 Eppendorf 管中并储存。
SDS-PAGE 蛋白质分析
SDS-PAGE 采用 Hames (1990) 描述的方法进行,并根据 Jason 和 Ryde′n (1998) 进行了修改。在凝胶(1×5 毫米厚和 125 毫米长)上分离蛋白质,凝胶在 Hoefer SE 600 双冷却垂直平板单元(Hoefer Scientific Instruments,San Francisco,CA,USA)中运行。分离胶(12%,1×5 mol l)1 Tris-HCl pH 8×66,电导率为 17×5 mS)和浓缩胶(5% 0×5 mol l)1 Tris-HCl pH 6×68电导率为 28-33×5 mS) 由含有 29×2% (m × v) 丙烯酰胺 (BDH Electran, Lutterworth, UK) 和 0×8% (m × v) N1-N1-双亚甲基丙烯酰胺的单体溶液制备而成(BDH 电子)。倒入分离凝胶后,用butan-1-ol 覆盖。使分离凝胶聚合30分钟。聚合后,butan-1-ol 被去除,在加入浓缩胶之前,用蒸馏水洗涤凝胶3次。然后用塑料覆盖凝胶并使浓缩凝胶聚合过夜。将样品在 100°C 下煮沸 10 分钟,然后将每个样品的 2 升上样到凝胶上。电泳在 22 mA 恒定电流下通过浓缩胶(1 小时 45 分钟),并在 32 mA 下通过分离胶(3 小时 15 分钟)在 20 ℃下进行。
蛋白质染色
在室温下,凝胶在含有比例为 1:4:2 的考马斯蓝储备溶液、甲醇和乙酸的溶液中染色 1 小时。然后凝胶在室温下在含有比例为 5:2:20 的甲醇、乙酸和双蒸水的溶液中脱色过夜。然后使用 Amersham Pharmacia Biotech ImageScanner 扫描凝胶。
结果
阳极液的性质
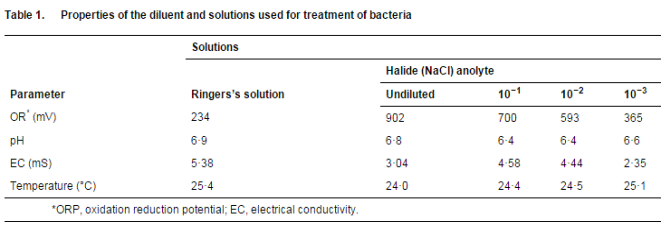
表 1 显示了所用溶液的特性。阳极液的 ORP 值为 902 mV,这归因于溶液中存在氧化剂(表 2)。在稀释时观察到未稀释的阳极液溶液的原始 ORP 值降低。ORP 的降低反映了阳极液的杀菌效果降低(表 2 和表 3)。溶液的 pH 值在溶液稀释后变化不大。阳极液的电导率在稀释时波动(表 1)。
卤化物阳极电解液最低抑菌浓度的测定
未稀释的阳极电解液在暴露后立即消除了所有测试微生物(表 3)。
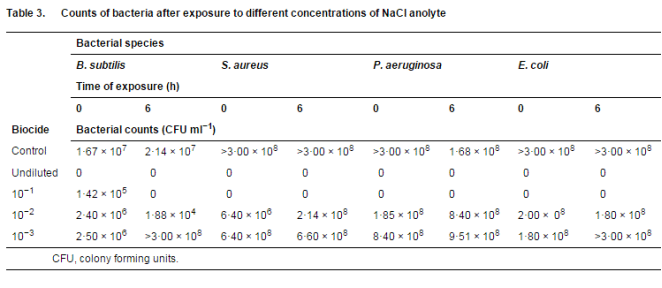
10-1 阳极液稀释液在暴露后立即完全消除了所有测试微生物,除了枯草芽孢杆菌,其数量在暴露后立即从 1×67·107 减少到 1×42·105 CFU g)1(表 3 )。然而,在 6 小时的暴露期后,所有的枯草芽孢杆菌细胞都被这种浓度的阳极液杀死。10-2 阳极液稀释液减少了所有测试生物的存活数量,而 10-2 阳极液稀释液对任何测试生物体均未观察到杀菌效果(表 3)。因此,可以得出结论,卤化物阳极电解液的 MIC 是 10-1 稀释度。
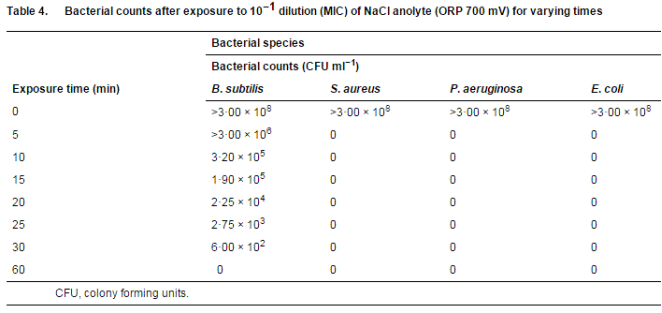
确定最短曝光时间
当测试生物体暴露于卤化物阳极电解液的 MIC 时,仅在暴露 5 分钟后就观察到所有测试生物体的 100% 杀灭效果,除了枯草芽孢杆菌,其从 >3×00·108 降低到 > 3×00 × 106 CFU ml)1(表 4)。这些数字在 30 分钟暴露期后进一步下降至 6×00·102 CFU ml)1,并在 60 分钟后最终降至 0(表 4)。该结果表明,枯草芽孢杆菌对阳极液暴露的抵抗力最强。卤化物阳极电解液 MIC 的有效杀菌作用的最短暴露时间对于枯草芽孢杆菌为 1 小时,对于所有其他测试生物体为 5 分钟。
用卤化物阳极电解液处理后细菌细胞的蛋白质分析
铜绿假单胞菌
未经处理的细菌的蛋白质谱不同于阳极液处理的细菌。用不同浓度的阳极液处理的细菌的蛋白质谱也不同。对于未处理的铜绿假单胞菌,观察到几个蛋白质条带(图 1,泳道 1),而对于用阳极电解液处理的相同细胞,观察到的条带较少。10-1 阳极电解液处理的细胞有一条带。用 10-2 稀释度处理的细菌有 3 个条带(图 1,泳道 1、2 和 3)。处理过的细菌的蛋白质条带强度低于未处理的细胞,而 10-1 阳极液处理的细胞的强度低于 10)2 阳极液处理的细胞(图 1,泳道 2 和 3)。
大肠杆菌
大肠杆菌的结果与铜绿假单胞菌的结果不同。与对铜绿假单胞菌的观察结果相似,用 10-1 稀释液处理的大肠杆菌细胞的蛋白质条带少于未处理细胞的蛋白质条带(图 1,泳道 4 和 5)。然而,10-2 稀释减少了活细胞的数量,也导致了更多的蛋白质条带(图 1,泳道 6)。
讨论
阳极液减少了活细菌的数量,并且随着阳极液的逐渐稀释和 ORP 的降低,杀生物效果下降。在细菌菌株暴露于未稀释的阳极液后,蛋白质条带的数量减少。这表明阳极液可能通过破坏细胞蛋白质导致细菌死亡。这些结果与 Zinkevich 等人的研究结果一致。(2000) 在将大肠杆菌暴露于 ORP 为 1000 mV 的阳极液溶液后,他还观察到蛋白质条带的消失。阳极电解液中存在的氧化性化合物可能通过破坏蛋白质中的共价键来破坏蛋白质(Zinkevich 等人,2000 年)。
10-2 阳极液稀释破坏了铜绿假单胞菌的蛋白质,但在大肠杆菌中,与未经处理的细菌的蛋白质谱相比,它导致出现更多的蛋白质条带。与未经处理的细菌中存在的天然蛋白质相比,额外的蛋白质条带的分子量既低又大。低分子量蛋白质条带可能是由于蛋白质片段化成更小的肽段所致(Janig 等人 2005;Li 等人 2005)。稀释的阳极液的存在导致了不利的环境条件,从而引起了细菌的应激反应。应激反应的水平随生物类型和环境类型而变化(Kochhar 和 Kochhar 2005)。在暴露于压力条件下,细菌主要从回收的氨基酸中合成和替换受损的蛋白质,这可能会导致天然蛋白质的特征发生变化(Davies 2001)。此外,压力会启动多种防御基因的激活,这些基因编码反应性自由基和其他压力相关蛋白的清除剂(Aertsen 和 Michiels 2004;Kochhar 和 Kochhar 2005)。如所证明的,这种情况可能解释了额外的大分子量蛋白质条带的存在。
结论
未经稀释的卤化物衍生阳极电解液在暴露后立即有效杀死所有测试细菌。10)1 稀释的阳极液对除枯草芽孢杆菌以外的所有测试细菌都观察到相同的杀灭效果,枯草芽孢杆菌表现出最大的抗性。通过 10)1 阳极液稀释完全消除枯草芽孢杆菌的暴露时间为 6 小时。阳极电解液通过干扰其蛋白质组成来杀死铜绿假单胞菌和大肠杆菌细菌,由于氧化应激而完全或部分降解蛋白质。
安柯孚莱(北京)环保技术有限公司
网站新闻
推荐
-

-

QQ空间
-

新浪微博
-

人人网
-

豆瓣

